
Au-delà des gènes
Les fuites dans l'inactivation du chromosome X

Légende :
Comparaison des chromosomes X et Y.
Le chromosome X est plus grand et contient plus de gènes (815 gènes chez l'homme). Le chromosome Y est plus petit (45 gènes). La majorité des gènes sur le chromosome X ne possèdent pas de seconde copie sur le chromosome Y. Chez les mâles (XY), les mutations de ces gènes sur le X ne sont pas compensées par une copie intacte. Par conséquent, les hommes sont plus sensibles à un certain nombre de maladies liées à l’X (tels que le daltonisme ou la dystrophie musculaire de type Duchenne).
La première image montre une représentation des deux chromosomes avec quelques gènes, tandis que la deuxième présente une vue au microscope électronique à balayage.
Chez un individu femelle on retrouve deux chromosomes X, tandis que chez un mâle nous retrouvons un chromosome X et un Y.
Le chromosome X est très grand, il possède plus de 150 millions de paires de base qui codent pour plus de 1 000 gènes dont beaucoup sont essentiels pour le maintient de la vie de la cellule. Le chromosome Y est beaucoup plus petit et porte donc beaucoup moins de gènes.
source : Bioninja
La présence de chromosomes sexuels différents peut poser des problèmes à l'organisme, en voici quelques exemples :
-
L'appariement durant les divisions cellulaires est plus compliqué qu'avec des paires d'autosomes qui sont homologues.
-
Cette dissemblance des chromosomes X et Y peut entrainer des maladies car nous retrouvons qu’une seule copie des gènes sur la paire de chromosome sexuel (pas toujours d’équivalence entre les gènes du X et du Y) et donc quand une mutation apparait sur l’un de ces gènes il y a un impact sur l'organisme qui peut-être dangereux, car il n'y a plus aucune copie de ce gène.
-
Nous pouvons aussi parler de dose. En effet dans l'organisme, les erreurs dans le nombre de chromosome sont souvent létales. Par exemple, la seule trisomie qui est viable est la trisomie 21, le chromosome 21 étant un petit chromosome. Toutes les autres trisomies sont létales. Donc cette différence de taille des chromosomes sexuels peut poser problème à l'organisme.
Nous allons nous étendre sur le dernier exemple : Comment les organismes font-ils pour compenser la différence de dose entre des cellules contenant les chromosomes XY et celles contenant XX ?
C'est là que rentre en jeu le système de l'inactivation d'un chromosome X des cellules femelles chez les Humains.
C'est un des systèmes de compensation de dose mais pas le seul qui existe dans la nature. Chez les drosophiles, le chromosome X chez le mâle est deux fois plus exprimé pour arriver à produire autant de protéines que les chromosomes X des cellules femelles. Alors que chez le ver, on constate une baisse de moitié dans l'activité de chaque chromosomes X des cellules femelles.
Chez les cellules femelles humaines, le chromosome X inactif est entouré par un ARN non codant et est accompagné d'une panoplie de modifications épigénétiques, jouant aussi bien au niveau de la composition de la chromatine que de sa structure. Cependant nous savons que tous les gènes de ce X n'ont pas besoin d'être réprimés pour avoir une bonne compensation de dose. Nous pouvons donc pensé qu'au cours de l'évolution le système à évolué : au début seulement les gènes qui pouvaient être létals si surexprimés étaient bloqués. Ensuite est apparu le blocage avec les ARN non-codant qui est plus efficace et qui bloque le chromosome en entier.
Pourtant certains gènes arrivent à échapper à cette inactivation : des fuites dans l'inactivation.
Chez l'humain, environ 15% des gènes sur le chromosome X inactif peuvent échapper à
cette inactivation et donc être fonctionnels. On a alors l'expression des deux copies
du gène, l'une provenant du X inactif et l'autre du X actif.
Quels sont les gènes concernés ?
Les gènes échappant à l'inactivation sont localisés sur tout le chromosome Xi (chromosome X Inactif). Cependant on retrouve une zone dans laquelle la concentration en ces gènes est importante : la région PAR.
Les gènes situés dans les zones PAR s'expriment donc sur le chromosome X et Y dans les cellules mâles. Donc il est naturel qu'ils s'expriment également en couple dans les cellules XX. En terme de compensation de dose, c'est équivalent.
De même les gènes du X qui ont une copie sur le chromosome Y échappent souvent à l'inactivation même s'ils ne sont pas dans cette zone PAR.
Enfin on remarque que certains gènes ne sont pas sur le Y mais ne sont pas inactivés sur le Xi.
La distribution des gènes qui échappent à l'inactivation ne semble pas être entièrement aléatoire. De plus les gènes inactivés sont souvent regroupés dans les mêmes zones, ils sont adjacents.
Le nombre et le type de gène inactivé peut varier. Cette variabilité se retrouve entre différents individus, au sein des différents tissus d'un même organisme ou encore de chaque cellule individuelle d'un même tissu.
L'expression des gènes depuis le Xi peut aussi évoluer et se modifier au cours du développement et de la vie de l'organisme.
Processus moléculaires des fuites dans l'inactivation
Quand l’ARN XIST arrive et déclenche l’inactivation, nous observons sur ces parties de chromosomes concernées, une perte des facteurs de transcription et de la polymérase. Ensuite des marques épigénétiques sont mises en place pour maintenir l’inactivation.
L’ARN XIST est d’abord en activité sur certaines régions du chromosome, les gènes ne sont pas tous enrobés. Et progressivement, pendant les stades précoces du développement, d’autres gènes commencent à être inactivés en rentrant dans le compartiment couvert par XIST.
Les seuls gènes qui restent en dehors de ce domaine décoré par XIST, sont les gènes qui échappent à l’inactivation.

Légende :
Ce modèle montre que la partie inactive du chromosome Xi est recouverte de l'ARN non-codant XIST (nuage rose). Dans cette partie inactive, des marques épigénétiques de répression de la transcription sont présentes : H3K27me3, H3K9me3, macroH2A (cercle vert) ainsi que la méthylation de l'ADN (boules noires).
Au contraire, la région du chromosome Xi qui échappe à l'inactivation n'est pas décorer par l'ARN XIST. De plus, elle porte des marques épigénétiques d'activation de la transcription : l'acétylation de H3 et H4, H3K4me3 et les ilots CpG sont déméthylés (boules blanches).
Le site de transition entre l'euchromatine (région sans inactivation) et l'hétérochromatine (région avec inactivation), n'est pas encore bien connu. Mais cette liaison pourrait être assurée par le facteur CTCF, codé par le gène CTCF chez l'humain. Il empêcherait la dispersion de l'hétérochromatine dans la région active, et vice versa.
Le pourcentage de gènes échappant à l'inactivation peut varier selon les espèces, par exemple chez la souris seulement 3% des gènes sont concernés.
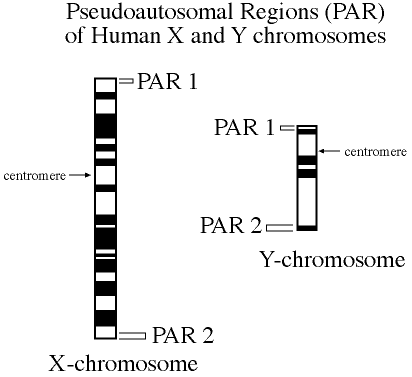
La région PAR = Pseudo-autosomale région
C'est une région qui est homologue aux chromosomes X et Y, nous retrouvons deux parties PAR1 et PAR2 situés aux extrémités de chaque chromosome.
source : quora
source : Genes that escape from X inactivation, Joel B. Berletch
Comment cet état est-il maintenu ?
Comme évoqué dans la figure précédente, le facteur de transcription CTCF serait un acteur dans le maintient de la stabilité du système hétérochromatine/euchromatine. Il se positionnerait à la frontière entre la région active et inactive pour empêcher l'invasion de l'une vers l'autre. Cette région de transition serait donc indispensable au bon fonctionnement et maintient de la structure.

Un facteur de transcription est une protéine nécessaire à l'initiation ou à la régulation de la transcription d'un gène.
Légende :
Le rôle principal de CTCF est de réguler la structure tridimensionnelle de la chromatine. CTFC définit également la limite entre l'hétérochromatine inactive et l'euchromatine active.
Les nucléosomes qui sont directement associés avec CTCF sont apparus comme possédant des marques actives (comme H3K4me3). De plus, CTCF est localisé entre deux domaines possédant des marques différentes. Le domaine de l'euchromatine est associé avec des marques actives comme l'acétylation et une augmentation des processus de transcription. Au contraire, le domaine de l'héterochromatine est marqué par l'augmentation de H3K27me3 et d'un processus de transcription peu efficace.